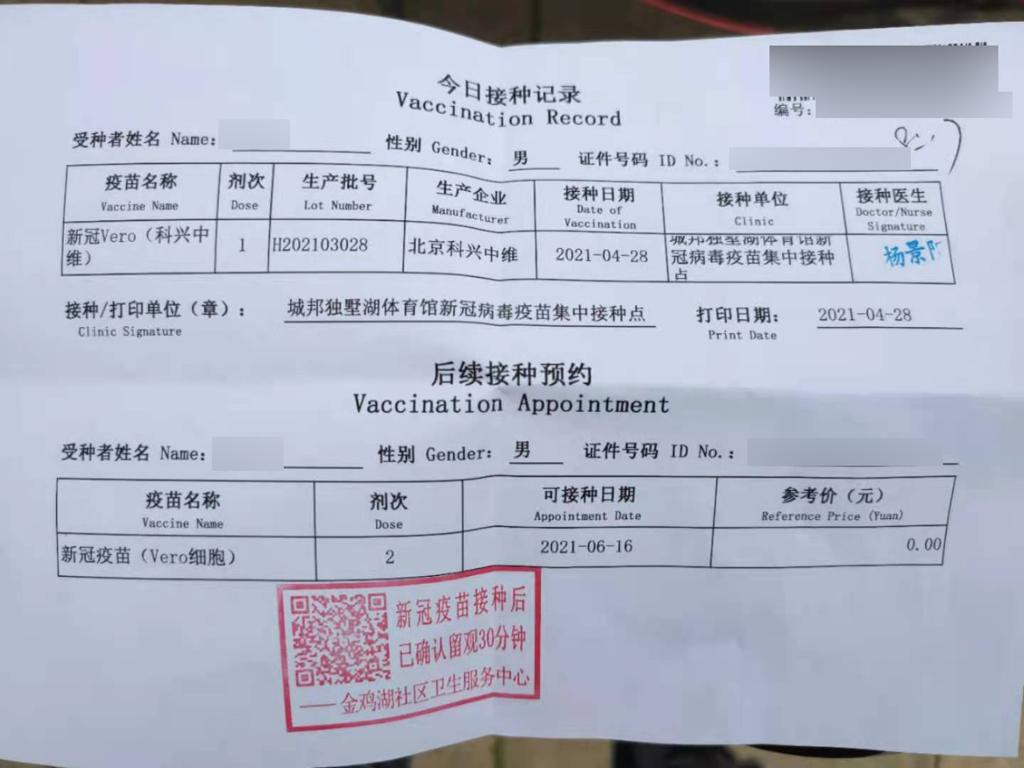
北京科兴中维 Vero细胞
国家药监局附条件批准北京科兴中维生物技术有限公司新型冠状病毒灭活疫苗(Vero细胞)注册申请
”标题
国家药监局附条件批准北京科兴中维生物技术有限公司新型冠状病毒灭活疫苗(Vero细胞)注册申请
发布日期
2021-02-06
2月5日,国家药品监督管理局附条件批准北京科兴中维生物技术有限公司的新型冠状病毒灭活疫苗(Vero细胞)注册申请。该疫苗适用于预防新型冠状病毒感染所致的疾病(COVID-19)。
国家药监局根据《疫苗管理法》《药品管理法》相关规定,按照药品特别审批程序,进行应急审评审批,附条件批准上市注册申请。国家药监局要求该疫苗上市许可持有人继续开展相关研究工作,完成附条件的要求,及时提交后续研究结果。“
附条件 批准
后续要提交研究结果(防止有问题)
新冠病毒疫苗接种技术指南(第一版)
【总结】
- 新冠病毒
- 疫苗种类
- 灭活疫苗
- 已(附条件批准的)上市产品
- 国药集团中国生物北京生物制品研究所有限责任公司(北京所)
- 武汉生物制品研究所有限责任公司(武汉所)
- 北京科兴中维生物技术有限公司(科兴中维)
- 产品名:克尔来福
- 概述
- 不含防腐剂
- 适用于18岁及以上人群的预防接种
- 用于预防新型冠状病毒感染所致的疾病
- 基础免疫程序为2剂次
- 间隔14-28天
- 每一次人用剂量为0.5ml
- 研发过程概述
- 2020年1月:多组研究人员分赴浙江、北京的5个P3实验室同步开展毒株筛选、工艺研究、检定方法建立及验证等工作
- 与合作单位专家团队短时间内完成疫苗全部临床前研究工作
- 确诊新冠病人分离筛选得到疫苗生产用毒株CZ株
- 按GMP要求建立疫苗生产用三级毒种库
- 确定疫苗制备工艺,建立关键检定方法
- 对疫苗进行单次给药毒性试验、过敏原性试验、重复给药毒性试验等安全性评价
- 2020年5月:发表于《科学》杂志上的克尔来福临床前研究结果显示,克尔来福在恒河猴模型中安全有效,这也是全球首个新冠疫苗动物实验研究结果
- 2021年2月:形成正式的Ⅲ期临床研究医学报告提交CDE
- 2021年2月3日:提出附条件上市申请
- 克尔来福境外(巴西、智利,东南亚的印尼和中东的土耳其等地,多中心、随机、双盲、安慰剂平行对照设计)Ⅲ期临床保护效力试验两个月的结果
- 暂未获得最终分析数据,有效性和安全性结果尚待进一步最终确证
- 2021年2月6日:附条件上市申请通过
- 国家药监局要求该疫苗上市许可持有人继续开展相关研究工作,完成附条件的要求,及时提交后续研究结果
- 相关
- 一支新冠灭活疫苗从实验室走向市场所需:七大步骤
- 细胞培养、病毒培养、灭活、纯化、配比(半成品)、灌装、包装
- 原理:
- 使用非洲绿猴肾(Vero)细胞进行病毒培养扩增,经β丙内酯灭活病毒,保留抗原成分以诱导机体产生免疫应答,并加用氢氧化铝佐剂以提高免疫原性
- 用新型冠状病毒(CZ02株)接种非洲绿猴肾细胞(简称Vero细胞),经培养、收获病毒液、灭活病毒、浓缩、纯化和氢氧化铝吸附制成
- 腺病毒载体疫苗
- 已(附条件批准的)上市产品
- 康希诺生物股份公司(康希诺)
- 重组新冠病毒疫苗(5型腺病毒载体)
- 原理
- 将新冠病毒的刺突糖蛋白(S蛋白)基因重组到复制缺陷型的人5型腺病毒基因内,基因重组腺病毒在体内表达新冠病毒S蛋白抗原,诱导机体产生免疫应答
- 重组亚单位疫苗
- 已(获批紧急使用的)上市产品
- 安徽智飞龙科马生物制药有限公司(智飞龙科马)
- 重组新冠病毒疫苗(CHO细胞)
- 原理
- 将新冠病毒S蛋白受体结合区(RBD)基因重组到中国仓鼠卵巢(CHO)细胞基因内,在体外表达形成RBD二聚体,并加用氢氧化铝佐剂以提高免疫原性
- 推荐免疫程序
- 适用对象
- 18周岁及以上人群
- 接种剂次和间隔
- 新冠病毒灭活疫苗(Vero细胞)
- 接种2剂
- 2剂之间的接种间隔建议≥3周
- 第2剂在8周内尽早完成
- 重组新冠病毒疫苗(5型腺病毒载体)
- 接种1剂
- 重组新冠病毒疫苗(CHO细胞)
- 接种3剂
- 相邻2剂之间的接种间隔建议≥4周
- 第2剂尽量在接种第1剂次后8周内完成
- 第3剂尽量在接种第1剂次后6个月内完成
- 接种途径和接种部位
- 推荐上臂三角肌肌内注射
- 其他有关事项
- 迟种补种
- 对2剂或3剂次程序的疫苗,未按程序完成接种者,建议尽早补种。免疫程序无需重新开始,补种完成相应剂次即可
- 对在14天内完成2剂新冠病毒灭活疫苗接种者,在第2剂接种3周后尽早补种1剂灭活疫苗。对在14-21天完成2剂新冠病毒灭活疫苗接种的,无需补种
- 加强免疫
- 现阶段暂不推荐加强免疫
- 与其他疫苗同时接种
- 暂不推荐与其他疫苗同时接种。其他疫苗与新冠病毒疫苗的接种间隔应大于14天。当因动物致伤、外伤等原因需接种狂犬病疫苗、破伤风疫苗、免疫球蛋白时,可不考虑与新冠病毒疫苗的接种间隔
- 不同疫苗产品替换
- 现阶段建议用同一个疫苗产品完成接种。如遇疫苗无法继续供应、受种者异地接种等特殊情况,无法用同一个疫苗产品完成接种时,可采用相同种类的其他生产企业的疫苗产品完成接种
- 新冠病毒感染及抗体筛查
- 在疫苗接种前无需开展新冠病毒核酸及抗体检测;接种后也不建议常规检测抗体作为免疫成功与否的依据
- 接种禁忌
- 通常的疫苗接种禁忌包括
- (1)对疫苗的活性成分、任何一种非活性成分、生产工艺中使用的物质过敏者,或以前接种同类疫苗时出现过敏者
- (2)既往发生过疫苗严重过敏反应者(如急性过敏反应、血管神经性水肿、呼吸困难等)
- (3)患有未控制的癫痫和其他严重神经系统疾病者(如横贯性脊髓炎、格林巴利综合症、脱髓鞘疾病等)
- (4)正在发热者,或患急性疾病,或慢性疾病的急性发作期,或未控制的严重慢性病患者
- (5)妊娠期妇女
- 本指南对说明书中所列部分接种禁忌或慎用人群,参照下述特定人群接种建议执行
- 特定人群接种建议
- (一)60岁及以上人群
- 60岁及以上人群为感染新冠病毒后的重症、死亡高风险人群。目前,4个附条件批准上市的新冠病毒疫苗Ⅲ期临床试验研究纳入该人群的数量有限,暂无疫苗对该人群的保护效力数据。但Ⅰ/Ⅱ期临床研究数据显示,该人群疫苗接种安全性良好,与18-59岁人群相比,接种后中和抗体滴度略低,但中和抗体阳转率相似,提示疫苗对60岁以上人群也会产生一定的保护作用,建议接种。
- (二)18岁以下人群
- 目前已有的疫苗尚未获得用于该人群的临床试验数据,暂不推荐18岁以下人群接种。
- (三)慢性病人群
- 慢性病人群为感染新冠病毒后的重症、死亡高风险人群。健康状况稳定,药物控制良好的慢性病人群不作为新冠病毒疫苗接种禁忌人群,建议接种。
- (四)育龄期和哺乳期女性
- 如果在接种后怀孕或在未知怀孕的情况下接种了疫苗,基于对上述疫苗安全性的理解,不推荐仅因接种新冠病毒疫苗而采取特别医学措施(如终止妊娠),建议做好孕期检查和随访。对于有备孕计划的女性,不必仅因接种新冠病毒疫苗而延迟怀孕计划。
- 虽然目前尚无哺乳期女性接种新冠病毒疫苗对哺乳婴幼儿有影响的临床研究数据,但基于对疫苗安全性的理解,建议对新冠病毒感染高风险的哺乳期女性(如医务人员等)接种疫苗。考虑到母乳喂养对婴幼儿营养和健康的重要性,参考国际上通行做法,哺乳期女性接种新冠病毒疫苗后,建议继续母乳喂养。
- (五)免疫功能受损人群
- 免疫功能受损人群是感染新冠病毒后的重症、死亡高风险人群。目前尚无新冠病毒疫苗对该人群(例如恶性肿瘤、肾病综合征、艾滋病患者)、人类免疫缺陷病毒(HIV)感染者的安全性和有效性数据。该类人群疫苗接种后的免疫反应及保护效果可能会降低。对于灭活疫苗和重组亚单位疫苗,根据既往同类型疫苗的安全性特点,建议接种;对于腺病毒载体疫苗,虽然所用载体病毒为复制缺陷型,但既往无同类型疫苗使用的安全性数据,建议经充分告知,个人权衡获益大于风险后接种。
- (六)既往新冠患者或感染者
- 现有研究数据表明,新冠病毒感染后6个月内罕见再次感染发病的情况。既往新冠肺炎病毒感染者(患者或无症状感染者),在充分告知基础上,可在6个月后接种1剂
- 其他事项
- 随着更多新冠病毒疫苗的获批使用、疫苗临床研究数据的不断完善以及疫苗上市后监测和评价数据的增加,根据疫情防控形势的需要,本指南将适时更新
转载请注明:在路上 » 【整理】新冠疫苗 北京科兴中维 Vero细胞